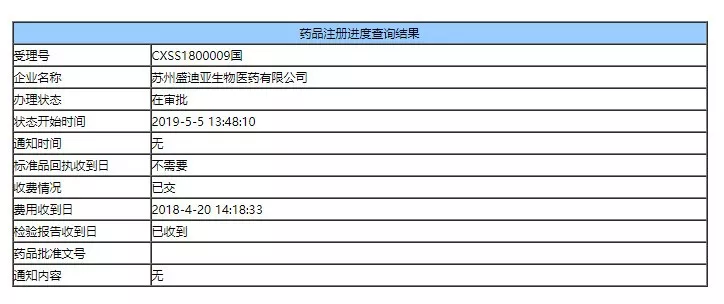
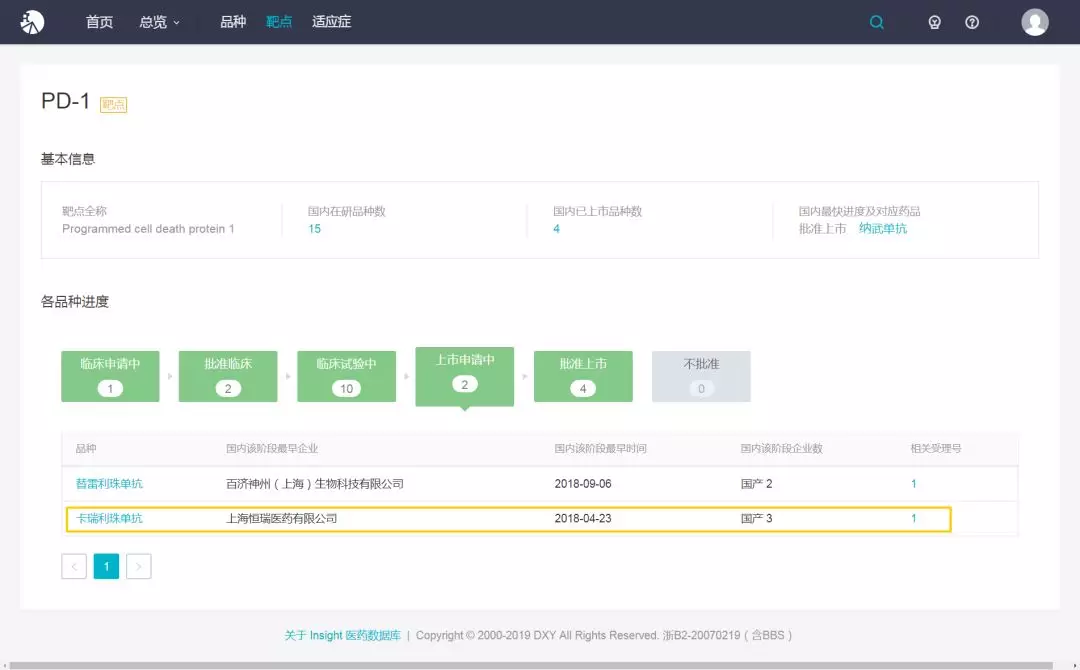
今日,恒瑞医药 PD-1「卡瑞利珠单抗」在国内的上市申请审批状态变更为「在审批」,知情人士向 Insight 数据库透露,卡瑞利珠单抗已获得 NMPA 批准上市,适应症复发/难治性霍奇金淋巴瘤(三线)。
卡瑞利珠单抗审评动态
卡瑞利珠单抗是国内制药龙头企业恒瑞医药研发的人源化抗 PD1 抗体卡瑞利珠单抗,研发代号 SHR-1210。
2014 年 12 月,恒瑞提交注射用 SHR-1210 临床注册申请并获受理。2016 年 2 月,获批临床试验,同年 11 月,获批进行 II、III 期临床试验。2018 年 4 月,因与现有治疗手段相比具有明显治疗优势,被纳入优先审评程序。
以下是 Insight 数据库(https://db.dxy.cn/)显示的卡瑞利珠单抗受理号时光轴
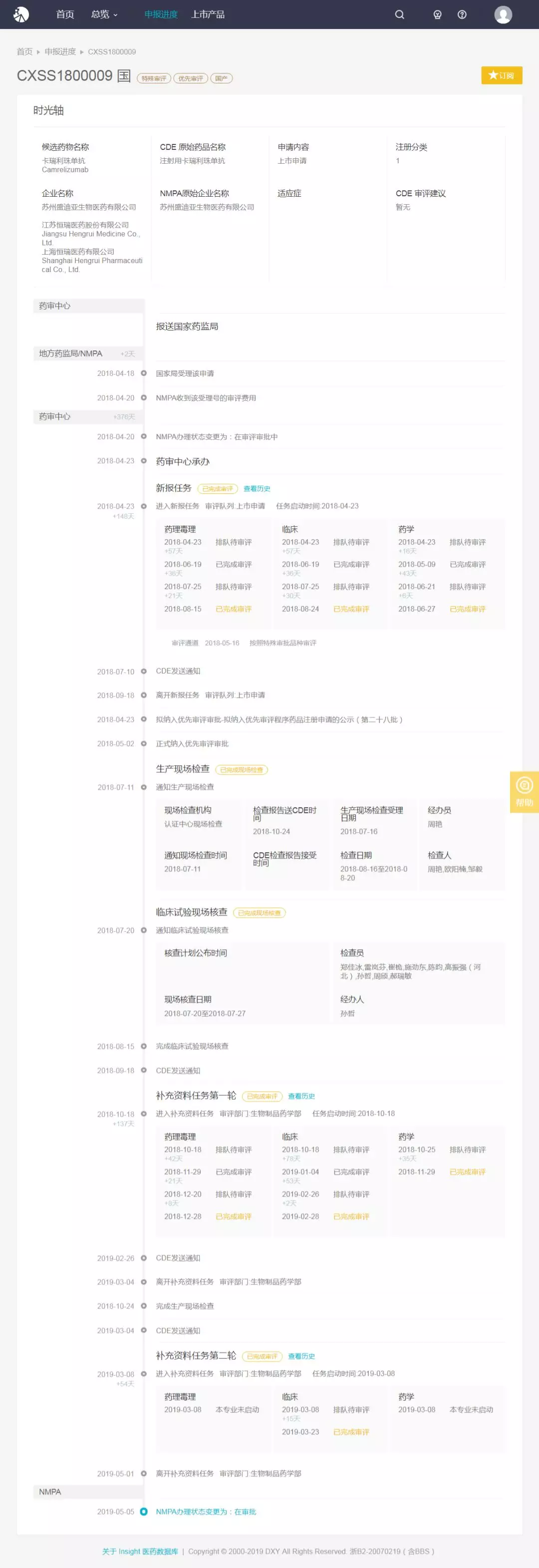
31 个临床试验,9 个处在 III 期
Insight 临床试验数据库显示,恒瑞同期开展 31 个 I~III 期临床试验。
目前处在 3 期的有 9 个,适应症分别是胃癌或胃食管交界处癌、晚期肝细胞癌、复发或转移性鼻咽癌、晚期食管癌和 IV 期鳞状非小细胞肺癌。
2018CSCO 学术年会上,恒瑞医药公布了卡瑞利珠单抗治疗复发/难治性经典型霍奇金淋巴瘤、晚期肝细胞癌的两项临床试验结果。
截止 2018 年 3 月 18 日(末例受试者入组后 6 个月),结果显示,卡瑞利珠单抗治疗复发/难治性经典霍奇金淋巴瘤 (cHL) 中展现出积极的有效性和安全性,其中客观有效率达到 84.8%,完全缓解率(CR)达到 30.3%,不良反应可耐受,除反应性皮肤毛细血管增生症之外,其他常见的不良反应与同类产品相当。
截止 2018 年 5 月 16 日,初步结果表明,对既往索拉非尼或以奥沙利铂为主的治疗失败或不耐受的晚期肝癌患者,卡瑞利珠单抗进行二线及二线以上治疗表现出较高的有效性和安全性。在受试者基线状况较差的情况下,卡瑞利珠单抗依然展现出客观缓解和生存获益相当的积极效果。
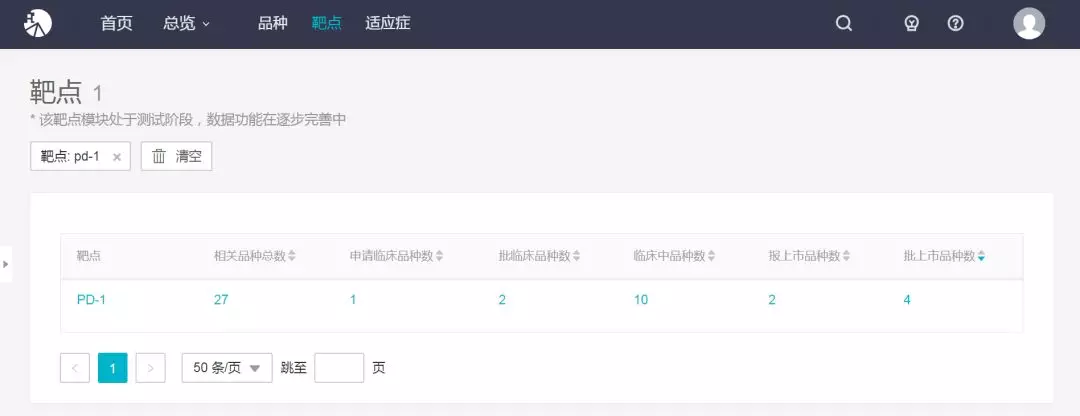
Pd-1 国内 27 个品种竞争
此前瑞银证券对肺癌、肝癌、胃癌和食管癌四种适应症的研究表示,到 2028 年,这四种适应症的市场规模或达 700 亿元,PD-(L)1 的市场总体规模有望达 1000 亿元。
目前国内竞争激烈,已有 27 款 PD-1 产品处在申报临床及其之后的状态。
第 5 个上市的 PD-1 ,恒瑞被看好
此前已有 4 款 PD-1 产品获批上市,与恒瑞同处在上市申请中的还有百济神州的替雷利珠单抗。
百时美施贵宝 Opdivo(纳武利尤单抗)
获批适应症:非小细胞肺癌
于2018年8月28日开售,2019年一季度销售额3亿元人民币
默沙东 Keytruda(帕博利珠单抗)
获批适应症:黑色素瘤、转移性非鳞状非小细胞肺癌
于2018年9月21日开售,2019年一季度销售额5亿元人民币
信达生物 信迪利单抗注射液(达伯舒)
适应症:霍奇金淋巴瘤
于2019年3月10日开售,2019年一季度销售额6700万
君实生物拓益(特瑞普利单抗)
获批适应症:黑色素瘤
于2019年2月26日开售,2019年一季度销售额7908万
业内人士表示,恒瑞卓越的销售能力十分强劲,很有可能后来者居上。
眼下,争取进入医保目录成各款 PD-1 产品市场争夺的关键,刚获批上市的恒瑞 PD-1 能否争取到机会?我们拭目以待。