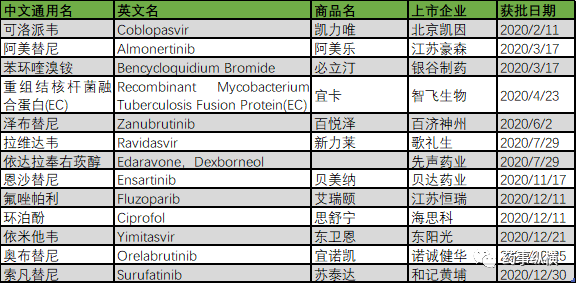
随着创新药相关政策的不断完善,近3年以来,我国创新药研究的氛围已经形成,资本市场非常活跃。2020年以来,NMPA已经批准了13个1类创新药(不含疫苗、细胞制品等FDA不认定为新药的产品),创下了历史前所未有的高度。这些产品中,近半数是通过优先审评审批程序获批上市,部分药物为有条件批准上市,新通道的建立,为创新药的审评审批逐渐扫清了准入障碍。笔者在此对2020年获批的13个1类创新药一一简单介绍,以为业内同仁提供初步的了解。文章经过校对,每一个数据都有参考文献可追溯,如有疑问可联系作者Voyager88,本文不允许其他媒体转载,严禁抄袭、摘取文章内容发表至其它平台,侵权必究。
1. 可洛派韦
2020年2月11日,NMPA批准了北京凯因的可洛派韦(凯力唯)。这是一种NS5A抑制剂,与索磷布韦联用,治疗初治或干扰素经治的基因1、2、3、6型成人慢性丙型肝炎病毒(HCV)感染,代偿性肝硬化患者也可以使用。本品的安全有效性在一项由HCV基因1型、2型、3型或6型患者参与的2期临床试验中得到证实,入组的无代偿性肝硬化患者按1:2的比例分别接受本品30mg和60mg联合索磷布韦治疗12周,而代偿性肝硬化患者则全部接受本品60mg联合索磷布韦治疗12周。结果显示,在参与临床试验的110名患者中,12周持续病毒学应答(SVR12)达98.2%(理解意向分析,ITT),一名基因6型的肝硬化患者出现肝炎复发,一名基因2型的肝硬化患者退出了临床试验,虽然两例患者出现了严重不良反应事件,但与本品和索磷布韦无关,大部分不良反应无需额外治疗[39]。根据《丙型肝炎防治指南(2015年更新版)》,我国丙肝无基因4型和5型HCV感染者[10],因此我国所有的患者均可以使用。尽管凯因的索磷布韦仿制药已经获批,但索磷布韦化合物专利尚未到期,当前治疗成本因索磷布韦价格高昂而相比其它鸡尾酒没有显著性优势,故本品的市场潜力可能要在索磷布韦化合物专利到期后才能彰显,当然该公司也可以与吉利德达成商业授权、专利和解或挑战专利来解决这一问题。
2. 阿美替尼
2020年3月17日,NMPA通过优先审评审批程序附条件批准了豪森的阿美替尼(阿美乐),用于既往经EGFR(表皮生长因子受体)抑制剂治疗后进展的,EGFR T790M突变阳性的局部晚期或转移性非小细胞肺癌成人患者治疗。阿美替尼的临床终点尚未达到,但因为疗效优异,获得有条件批准上市。在一项开放标签的1期临床试验中,结果显示在94名EGFRT790M突变患者中,客观缓解率和疾病控制率分别为52%和92%,中位无进展生存期为11.0个月[40]。肺癌的发病率居于恶性肿瘤首位,我国NSCLC患者超过 40% 是 EGFR显阳性,而EGFR敏感突变患者经过一代或二代的EGFR抑制剂治疗一定时间后,疾病会出现进展,其中过半数是 T790M 突变所导致。本品是继奥西替尼之后,第二个获得NMPA批准的三代EGFR抑制剂。奥西替尼售价高昂,本品的获批将是无数肺癌患者的福音。
3. 苯环喹溴铵
2020年3月13日,NMPA批准了银谷制药的苯环喹溴铵鼻喷剂。这是一种选择性M胆碱能受体拮抗剂,用于改善变应性鼻炎引起的流涕、鼻塞、鼻痒和喷嚏症状。一项有720名中国患者参与的3期临床试验证明了本品的安全有效性。入组患者被1:1随机分成2组,分别接受本品(每个鼻孔90微克)或安慰剂治疗4周,每次访视时,医生随机完成鼻镜检查,每天视觉模拟评分法(VAS)流涕,打喷嚏,鼻塞,瘙痒和总体症状。试验结束时,本品治疗组和安慰剂的视觉模拟评分分别相比基线下降4.83 ± 2.35分和2.46 ± 2.34分。两组间存在显著性差异,其中流涕相比基线下降72.32%,明显高于安慰剂组的31.03%,其它症状和总体症状的VAS评估结果也相比安慰剂有明显改善。两组患者不良反应类似,无严重不良反应[41]。变应性鼻炎是一种非常常见的疾病,《变应性鼻炎诊断和治疗指南(2015年,天津)》显示,我国大陆地区变应性鼻炎患病率高达4%~38%(不同地区有较大差异,大部分地区在10%左右)[42],受困扰人群规模巨大,本品的获批将为患者提供一种全新的治疗选择。
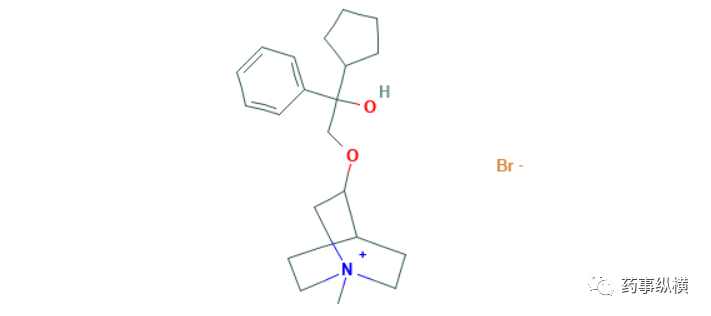
4. 重组结核杆菌融合蛋白(EC)
2020年4月23日,智飞生物的重组结核杆菌融合蛋白EC(EC,结核分枝杆菌早期分泌性抗原靶点6<ESAT-6>和培养滤液蛋白10<CFP-6>)获得NMPA批准上市,用于结核杆菌感染筛查、联合结核菌素纯蛋白衍生物(PPD)鉴别卡介苗接种与结核杆菌感染、区分卡介苗接种后阴转或未感染结核杆菌、卡介苗接种后维持阳性、结核杆菌感染。据WHO估算,我国结核发病人数达86.6万,占全球总发病人数的8.7%,因结核死亡病例达3.7万。我国是全球结核病的高负担国家之一,结核病病例与潜伏性感者基数庞大,有效识别结核病和结核潜伏感染对控制结核病疫情有重要意义。3期临床试验数据显示,在1559名健康者筛查中发现,EC与γ干扰素释放试验的检测结果高度一致(88.77%);791名结核患者筛查结果显示,EC敏感度为90.64%、结核感染T淋巴细胞斑点试验敏感度为90.15%、结核菌素纯蛋白衍生物检测敏感度为90.90%,三种检测方法具有较高的一致性;在479名未感染结核分枝杆菌病的筛查结果发现,EC与结核感染T淋巴细胞斑点试验的两次检测阴性一致率高达88.20%和93.17%;在卡介苗接种对检测结果影响的研究中发现,EC和结核感染T淋巴细胞斑点试验结果不受卡介苗影响;对394例临床诊断非结核性疾病患者的临床研究发现,EC与结核感染T淋巴细胞斑点试验的阴性一致率达87.21%[43]。
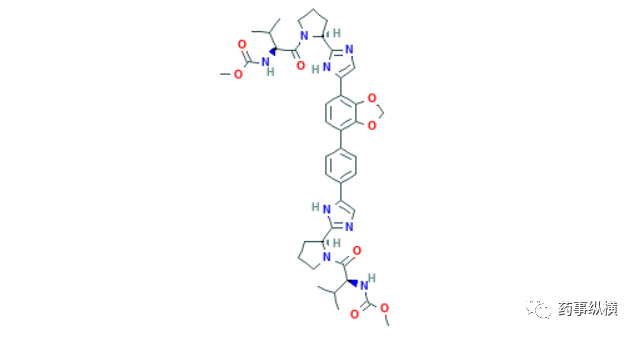
5. 泽布替尼
2020年6月2日,NMPA批准了百济神州的泽布替尼,这是一种选择性酪氨酸激酶(BTK)抑制剂,用于既往至少接受过一种治疗的成人套细胞淋巴瘤(MCL)患者和既往至少接受过一种治疗的成人慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者治疗。安全有效性方面,FDA说明书以及相关文献报道的临床试验部分资料显示,在一项开放标签、多中心的2期临床试验中,86名有治疗史的套细胞淋巴瘤患者接受本品160mg每日2次治疗,结果显示,客观缓解率为84%,其中59%完全缓解,24%部分缓解,中位持续缓解时间为19.5个月。另一项开放标签的1/2临床试验同样证明了泽布替尼的疗效,32名有治疗史的套细胞淋巴瘤患者接受本品160mg每日2次或320mg每日一次治疗,总客观缓解率依然是84%,其中22%完全缓解,62%部分缓解,中位持续缓解时间为18.5个月[44]。泽布替尼是我国自主研发[45],第一个获得FDA批准的“中国”新分子实体,代表着我国创新药从中国新到世界新的道路上,迈出了坚实的一步。
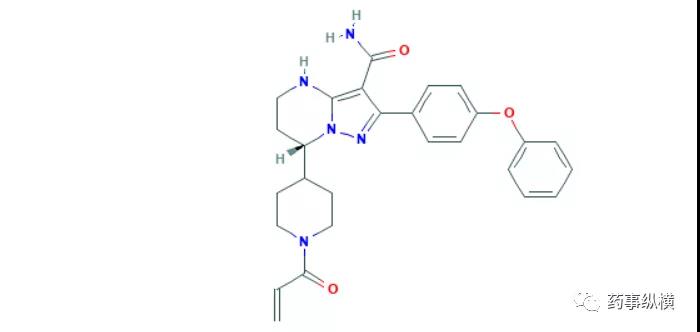
6. 拉维达韦
2020年7月29日,NMPA批准了歌礼的拉维达韦。这是一种NS5A抑制剂,联合利托那韦强化的达诺瑞韦钠片和利巴韦林,用于初治的基因1b型慢性丙型肝炎病毒感染的非肝硬化成人患者治疗。拉维达韦(Ravidasvir)最初由 Presidio 研发(PPI-668), 2014 年授权给歌礼。截至目前,文献已经报道了多项临床试验证明了其安全有效性,其中一项在中国开展的2/3期临床试验数据显示,424名基因1型初治患者,按3:1随机分组并分别给予拉维达韦200mg(每日一次)+ 利托那韦加强的达诺瑞位100mg/100mg(每日2次)+利巴韦林1000或1200mg或安慰剂治疗12周,结果显示治疗组12周的持续病毒学应答(SVR 12)率为99%,无患者出现严重不良反应[46]。另一项由基因1型、无肝硬化的初治患者参与的2期临床试验也证明了其疗效,结果显示38名患者(100%)全部达到SVR12,整个试验中未出现严重不良反应[47]。我国是丙肝大国,约有1000万HCV感染者,其中基因1b占56.8%[10],大部分患者收入较低,虽然艾伯维、吉里德等制药巨头的泛基因型丙肝鸡尾酒也进入了我国,但国产鸡尾酒将是中低收入患者的不二选择。
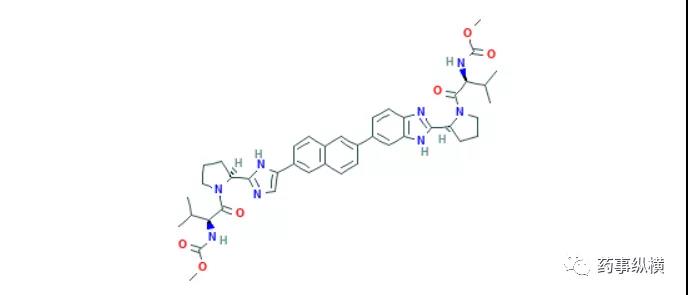
7. 依达拉奉右莰醇
2020年7月29日,NMPA批准了先声东元的1类新药依达拉奉右莰醇,用于急性缺血性卒中治疗。这是一种复方制剂,由依达拉奉与右莰醇以4:1的配比组成,依达拉奉是一种神经保护剂,已经在我国使用多年,右莰醇是新型的炎症抑制药物,可抑制脑缺血再灌注模型中炎性细胞因子TNF-α、 IL-1β的表达和致炎蛋白COX-2、iNOS的表达。在一项针对急性缺血性脑卒中 (AIS)患者设计的2期临床试验(NCT01929096)中,385名AIS患者在卒中发生后48小时内随机(1:1:1:1)接受本品12.5mg(低剂量)、本品37.5mg(中剂量)、本品62.5mg(高剂量)或依达拉奉30mg(对照组)持续治疗14天,主要终点为90天改良Rankin量表(mRS)评分≤1分的患者比例和14天内美国国立卫生研究院卒中量表(NIHSS)得分相比基线的变化情况。结果显示,低剂量组(n=94)、中剂量组(n=97)、高剂量组(n=98)和对照组(n=96)的90天mRS评分(≤1分,p=0.4054)和14天NIHSS评分(p=0.6799)变化均无统计学显著性差异。本品中剂量组、高剂量组的90天mRS评分≤1分的患者比例分别为69.39%和65.63%,略高于对照组的60.64%,试验证明不同剂量的本品与依达拉奉具有相同的安全性和可耐受性[48]。另有先声药业的官网信息显示,约1,200名急性缺血性脑卒中患者参与的随机、双盲、阳性对照、头对头比较的III期研究表明,对比单方依达拉奉注射液,依达拉奉右莰醇显示出明确的疗效优势、临床安全性相似,并大幅度将现有治疗时间窗从24小时延长至48小时。卒中是威胁公众健康的主要疾病之一,据文献报道,我国2013年就有1100万卒中患者,其中新确诊患者达240万人,卒中相关死亡病例高达110万人。不仅如此,我国人口结构正在高速老龄化,卒中的发病率仍在高速上升,本品的获批无疑为卒中的治疗提供一种全新的选择。
8. 恩沙替尼
2020年11月17日,NMPA批准了贝达的恩沙替尼,用于此前接受过克唑替尼治疗后进展的或者对克唑替尼不耐受的间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的治疗。一项开放标签的2期临床试验数据显示(NCT03215693),160名接受克唑替尼治疗后进展的IIIb或IV期ALK阳性NSCLC患者,接受本品治疗后,76名患者出现缓解,总缓解率为52%(76/147),在40例可测量的脑转移患者中,28名患者出现颅内缓解,常见不良反应为皮疹和转氨酶升高[49]。在另一项1/2期临床试验中,接受200mg以上剂量恩沙替尼治疗的患者,总缓解率为60%,中位无进展生存期为9.2个月,其中ALK抑制剂初治患者,总缓解率为80%,中位无进展生存期为26.2个月,仅既往接受过克唑替尼治疗的患者,总缓解率为69%,中位无进展生存期为9.0个月[50]。除了以上两项临床试验,一项名为eXalt3的全球多中心三期临床试验也得到了喜人的结果, 新一代ALK抑制剂中,成为最令人期待的产品之一。尽管ALK阳性患者仅占NSCLC的3%-7%[51],但如果能在全球范围内上市,最高年销售额超过5亿美元也非不无可能。
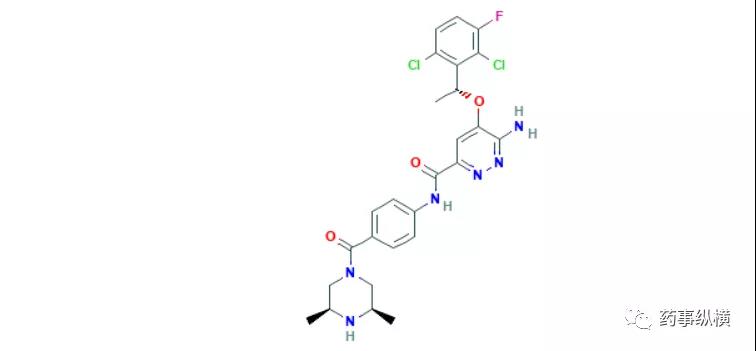 9. 氟唑帕利
9. 氟唑帕利
2020年12月11日,NMPA通过优先审评审批程序附条件批准了恒瑞的氟唑帕利胶囊(艾瑞颐),用于既往经过二线及以上化疗的伴有胚系BRCA突变(gBRCAm)的铂敏感复发性卵巢癌、输卵管癌或原发性腹膜癌患者的治疗。氟唑帕利是一种聚(ADP-核糖)聚合酶(PARP)抑制剂,对PARP1酶具有较强的抑制活性,可诱导DNA双链断裂、G2/M期阻滞和同源重组修复缺陷细胞的凋亡。此外,氟唑帕利对同源重组修复缺陷细胞具有更强的亲和力,可优先抑制同源重组修复缺陷细胞的增殖,并诱导同源重组修复缺陷细胞和同源重组修复娴熟细胞对细胞毒性药物敏感,从而增强化疗药的作用[52]。在一项针对复发性卵巢癌患者开展的多中心、开放标签的2期临床试验(NCT03509636)中,来自全国26个基地的113名BRCA1 或 BRCA2阳性的铂敏感患者,接受了150mg每日两次的氟唑帕利治疗,截止2019年4月15日,103名患者完成了疗效分析,结果显示客观缓解率(ORR)和疾病控制率 (DCR)分别为64.1%和95.1%,完全缓解率为8.7%,中位持续缓解时间和中位无进展生存期等数据尚未达到。与治疗相关的总不良发育发生率为95.6%,发生率超过20%的不良反应主要是恶心、乏力、白细胞减少、血红蛋白减少、中性粒细胞减少、食欲下降、血小板减少症(29.1%)和呕吐[53,54]。
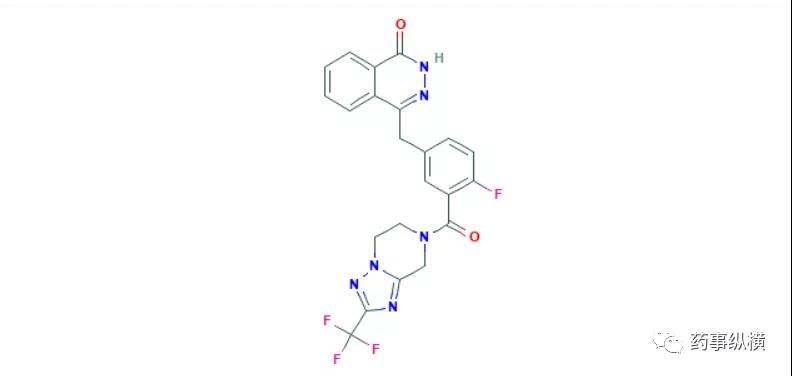
10. 环泊酚
2020年12月11日,国家药品监督管理局通过优先审评审批程序批准辽宁海思科的环泊酚注射液(思舒宁)上市,用于消化道内镜检查中的镇静。据海思科官网介绍,环泊酚属于GABA(γ-氨基丁酸)A受体激动剂,环泊酚注射液整体安全性耐受性良好,药效活性约为丙泊酚的5倍,快速平稳起效,苏醒迅速且完全,注射痛发生率极低,对呼吸的影响优于丙泊酚,对心率和血压的影响不劣于丙泊酚,脂质输入量小于丙泊酚。药动学试验(NCT03751956)数据显示,环泊酚在给药后,所有受试者均被快速麻醉(2分钟),并在短时间内(5.5-14.1分钟)顺利唤醒,几乎没有残留效应,不良反应为轻度,主要为低血压[55]。
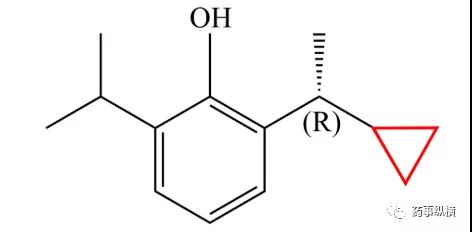
11. 依米他韦
2020年12月21日,国家药品监督管理局通过优先审评审批程序批准了东阳光的磷酸依米他韦胶囊(东卫恩),与索磷布韦联用,治疗成人基因1型非肝硬化慢性丙型肝炎。磷酸依米他韦是一种非结构蛋白(NS)5A抑制剂,在一项中国开展的临床研究结果显示,127例(98.4%)受试者在治疗结束后12周时HCVRNA载量低于检测限,100mg依米他韦+400mg索磷布韦治疗的63名患者组与200mg依米他韦+400mg索磷布韦治疗的64名患者组间无统计学差异,其中105名初治患者的SVR12为98.10%,24名既往接受过治疗患者的SVR12为100%[56]。尽管本品与吉里德的索磷布韦联用,效果非常出色,但索磷布韦在专利期内售价较高,治疗成本上并无优势。为了解决这一问题,东阳光正在与太景医药联合开发具有自主知识产权的丙肝鸡尾酒(依米他韦+伏拉瑞韦),目前已经处于三期临床阶段。
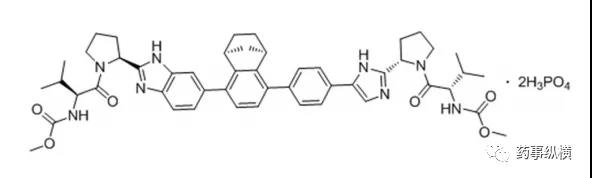
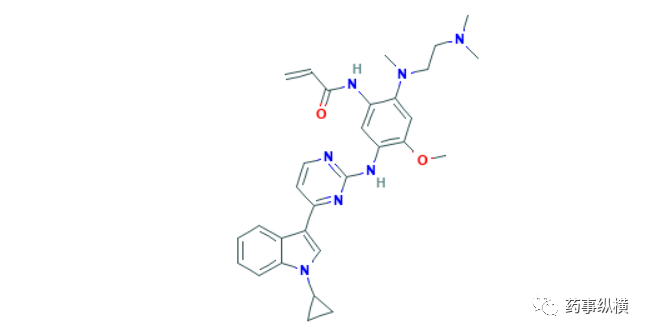
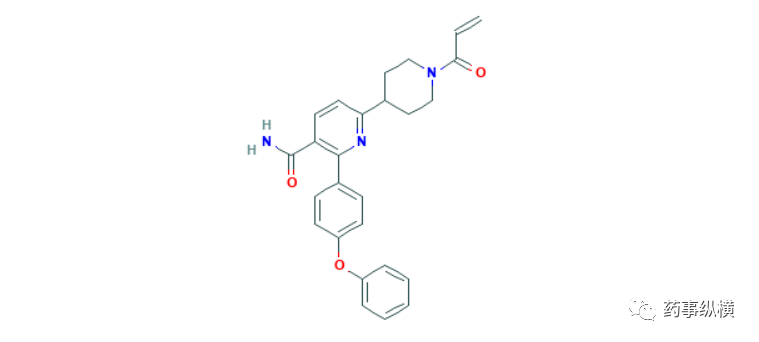
12. 奥布替尼
2020年12月25日,国家药品监督管理局通过优先审评审批程序附条件批准了北京诺诚健华医药的奥布替尼片(宜诺凯),用于既往至少接受过一种治疗的成人套细胞淋巴瘤(MCL)或慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)治疗。奥布替尼是一种二代强效BTK抑制剂,具有半衰期长、选择性高的特点[57]。在12月7日召开的第62届美国血液学协会(ASH)年会上,该公司公开了两项相关临床试验的早期数据。其中一项为针对难治或复发CLL/SLL患者设计的2期临床试验,80名难治或复发CLL/SLL中国患者接受了本品治疗,中位随访时间为14.3个月,总缓解率为91.3%,其中完全缓解率为10.0%,部分缓解率为63.8%,伴淋巴细胞增多的部分缓解率为17.5%。中位起效时间1.87个月,中位无进展生存期和持续缓解时间均未达到[58]。另外一项为针对MCL患者设计的多中心、开放性、临床2期试验,106名复发/难治性MCL患者接受了本品治疗,中位随访时间为16.4个月,总缓解率为87.9%,其中完全缓解率为34.3%,93.9%患者实现疾病控制,中位DOR和PFS均未达到[59]。CLL/SLL是西方国家较为常见的非实体瘤,美国年新发病例约为2万人,MCL相对罕见,美国年病例约为4千人。虽然CLL/SLL和MCL在亚洲人群的发病率较低,我国人口基数大,具有非常大的治疗需求,本品的获批有望惠及我国数万名患者。
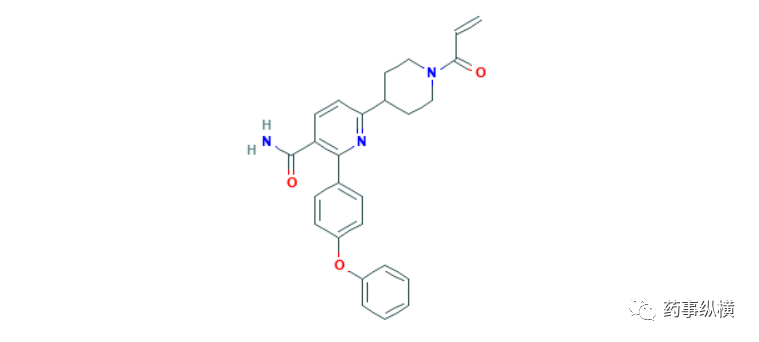
13. 索凡替尼
2020年12月30日,国家药品监督管理局通过优先审评审批程序批准和记黄埔医药的索凡替尼胶囊(苏泰达),用于无法手术切除的局部晚期或转移性、进展期非功能性、分化良好(G1、G2)的非胰腺来源的神经内分泌瘤治疗。索凡替尼(surufatinib)是一种血管内皮细胞生长因子受体(VEGFR)和成纤维细胞生长因子受体1(FGFR1)抑制剂,在一项3期临床试验(NCT02589821)中,176名转移性或不可切除、分化良好、既往接受治疗后进展的非胰腺神经内分泌瘤患者加入了临床试验,按2:1的比例随机分组并分别接受了本品(n=113)或安慰剂(n=59)治疗。结果显示索凡替尼治疗组的中位无进展生存期为10.9个月,而安慰剂为3.7个月,风险比为0.49。3级以上的不良反应包括高血压(38% vs 7%)、蛋白尿(10% vs 2%)、高胆固醇血症(7% vs 0%),总严重不良反应发生率分别为22%和7%[60]。另一项1b/2期临床试验也证明了本品的有效性,82名1年内放疗进展的胰腺神经内分泌瘤(n=42)或非胰腺神经内分泌瘤(n=39)接受了本品的治疗,结果显示胰腺神经内分泌瘤亚组的总缓解率为19%,非胰腺神经内分泌瘤亚组的总缓解率为15%,疾病控制率分别为91%和92%,中位无进展生存期分别为21.2个月和13.4个月,3级以上的不良反应为高血压(33%),蛋白尿(12%),高尿酸血症(10%),高甘油三酯血症(6%)和腹泻(6%)和丙氨酸转氨酶升高(5%)[61]。神经内分泌瘤是一种非常罕见的恶性肿瘤,年龄调整发病率为0.68/10万[60],神经内分泌肿瘤预后与肿瘤大小、发病部位、分级、分期有关,分化良好的G1、G2级神经内分泌瘤生存期为3年到20年不等,虽然此前已经有多个治疗神经内分泌瘤的产品上市,但本品的获批将为患者带来一种全新的治疗选择。
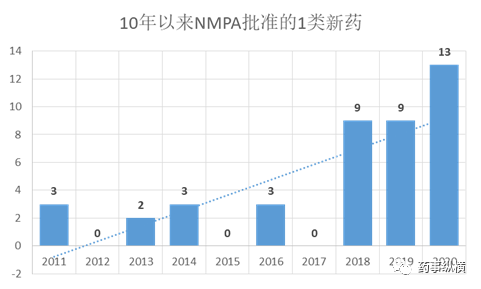
NMPA在2020年批准的1类新药